儿童抗肿瘤药物研发现状与思考
发布时间:2021-06-01 10:17:35
摘 要:
目的 儿童肿瘤是当前急需攻克的医疗难题之一。儿童肿瘤与成人肿瘤在发病机制、组织来源、基因驱动等方面存在较大差异,这导致儿童肿瘤在治疗方式和潜在治疗靶点与成人不同。虽然抗肿瘤药物始终是新药研发热点,但我国儿童抗肿瘤药物研发仍十分不足,导致超说明书用药在儿童抗肿瘤治疗过程中不可避免,增加了儿童用药的安全性风险。儿童用药安全、儿童专用药品短缺等成为备受关注的问题。近年来,儿童药品领域利好政策频出,国家药品监督管理局也发布多个儿童用药相关的指导原则,为儿童抗肿瘤药物开发提供了重要机遇。
关键词:
儿童用药; 抗肿瘤药; 新药研发
Current situation and consideration of development of pediatric anti-tumor drugs
TANG Ling GAO Liu-cun MA Xiao-li WANG Xiao-ling CHEN Xiao-ming ZOU Li-min DU Yu QI Yue-li YANG Zhi-min
Center for Drug Evaluation,National Medical Products Administration Clinical Research Center,Beijing Children's Hospital, Capital Medical University,National Center of Children 's Health Department of Medical Oncology,Beijing Children's Hospital, Capital Medical University,National Center of Children 's Health Department of Pharmacy,Beijing Children's Hospital, Capital Medical University,National Center of Children 's Health
Abstract:
Children cancer is one of the medical problems to be dissolved urgently. There are significant differences between paediatric cancer and adult cancer in pathogenesis, tissue origin, gene drive, etc., which leads to differences in treatment and potential therapeutic targets. Although anti-tumor drugs have always been a hot spot in the research and development of new drugs, it is still very insufficient for paediatric anti-tumor drugs in China. Consequently drug off-label use for children cancer treatment in clinical practice is inevitable, which increases the safety risk for paediatric drug use. Paediatric drug safety and shortage of specific paediatric drugs have become an issue with much attention. In recent years, favorable policies have been frequently published in the field of paediatric drugs. The National Medical Products Administration has also issued numerous guidelines related to paediatric drugs, providing important opportunities for the research and development of paediatric anti-tumor drugs.
Keyword:
paediatric drugs; anti-tumor drugs; new drug development;
在过去的几十年里,儿童肿瘤的发病率逐步增加[1]。虽然有数据显示近年来在儿童急性淋巴细胞白血病、非霍奇金淋巴瘤、横纹肌肉瘤死亡率有较大幅度下降,但是仍有许多肿瘤,如中枢神经系统肿瘤、急性髓细胞性白血病及1岁以上的高危型神经母细胞瘤治疗十分困难。即使在发达国家,癌症仍是1岁以上儿童疾病致死的主要原因[2],长期无瘤生存率也不过60%~80%。儿童肿瘤仍是当前急需攻克的医疗难题之一[3]。
纵观药物研发,抗肿瘤药物始终是新药研发热点,但与成人抗肿瘤药物研发热度相比,儿科肿瘤药的研发明显不足。特别是我国创新药研发处于起步阶段,儿童较成人抗肿瘤药物研发差距更大,有极大的临床需求亟待满足。许多儿童肿瘤仍依赖于成人药物的超适应症用药,用法用量很多是基于成人的临床经验,这无疑加剧了儿童用药安全风险。此外,由于儿童肿瘤与成人肿瘤疾病谱的不同,一些在儿童多发,或儿童特有的肿瘤,更是缺乏安全有效的治疗手段。
1 儿童肿瘤的特点
儿童肿瘤与成人有很大的不同。多数恶性程度高、发病隐匿,局部浸润和全身转移发生早,预后与病理、临床分期、基因状态等生物学特性密切相关,单一治疗效果差,预后与总体综合治疗方案密切相关。儿童肿瘤与成人肿瘤在发病机制、组织来源、基因驱动等方面存在较大差异,这是导致儿童肿瘤在疾病类型、症状、治疗方案与成人不同的主要原因[4]。
1.1 发病原因不同
儿童肿瘤的发病原因有其自身的特点:①儿童肿瘤发病早、发病年龄小。成人肿瘤的发生可能是在某一个或几个致病因素的长期作用下,发生一系列的病变累积,最后导致肿瘤形成。从发病年龄来看,儿童肿瘤多发生在2岁前,绝大部分甚至不超过5岁,很难以环境因素长期作用致癌的理论解释。②儿童肿瘤以间叶组织来源为主。从病理组织学看,儿童肿瘤多为各种胚胎组织肿瘤和肉瘤,如神经母细胞瘤、肾母细胞瘤、肝母细胞瘤等;间叶组织并不直接接触外界环境,间叶组织肿瘤更多的是机体内环境的反映;而成人肿瘤以上皮组织来源为主,如胃癌、肺癌、直肠癌等,上皮肿瘤主要与外界环境的作用有关。③儿童肿瘤多为胚胎性肿瘤。成人肿瘤主要表现为某一细胞成分的反分化,而儿童肿瘤往往是胚胎性肿瘤,肿瘤中包含数个组织成分,并常见不同发育阶段的成分共存。④儿童存在先天性肿瘤,有些儿童肿瘤于产前诊断中发现。先天性肿瘤的存在更彰显了儿童肿瘤与胚胎发育的关系[3]。
1.2 瘤种类型具有年龄分布特点
儿童肿瘤主要分为两大类,血液淋巴系统肿瘤和实体肿瘤,前者主要包括儿童白血病和淋巴瘤,约占儿童肿瘤45%左右。后者主要包括儿童中枢神经细胞肿瘤、以神经母细胞瘤为代表的母细胞瘤类、以横纹肌肉瘤为代表的肉瘤类、生殖细胞瘤以及少见实体肿瘤,占儿童肿瘤的50%以上。
从发生年龄来看,儿童期所发生的肿瘤按年龄划分主要有以下几个阶段:第1发病高峰为出生后至3岁以内,以先天性肿瘤为主,如各种母细胞瘤、胚胎性肿瘤、畸胎瘤等;第2个高峰在10岁以后,主要见于骨肉瘤、尤文肉瘤、霍奇金淋巴瘤、甲状腺瘤及神经纤维瘤,又称为青春期肿瘤;两个高峰之间为一般的儿童期肿瘤[3]。
1.3 基因驱动差异
目前对儿童肿瘤的遗传基础尚知之甚少。最近,2项研究分析了2 600多例儿童白血病和实体肿瘤的基因组,揭示了许多驱动儿童肿瘤的突变,既往在成人肿瘤中并未发现。
在第1项研究中,研究人员分析了来自24种不同类型儿童肿瘤的961例肿瘤样本,这些要本主要来自大脑和其他实体肿瘤。研究发现儿童肿瘤的突变率比成人肿瘤低14倍。儿童肿瘤往往由单个基因的突变而引起,而且不同类别的肿瘤突变不同,但成人肿瘤则往往是由多个基因累积突变引起;儿童肿瘤具有更多生殖细胞突变,近50%的原发性儿童肿瘤含有潜在的靶向遗传事件,提示遗传易感性与儿童期肿瘤具有相关性[5]。
与以往对成人肿瘤的研究相比,儿童肿瘤的突变和成人肿瘤也有明显差异。研究显示,在儿童肿瘤突变影响最多的通路中,以与表观遗传修饰相关的基因最为常见(约占25%);成人肿瘤中最常见基因突变是PI3K相关突变基因,占比为31%;而相比之下,在儿童肿瘤中只有3%。此外,研究中所发现的儿童肿瘤驱动突变中,只有30%既往在成人肿瘤中被报道过;50%的儿童肿瘤含有预测编码药物靶点的遗传变化[5]。这些研究结果进一步证明了开发适用于儿童肿瘤驱动机制相关药物的必要性。
在第2项研究中,研究人员分析了6种儿童肿瘤的1 699例样本,包括689例B系急性淋巴细胞白血病、267例T系急性淋巴细胞白血病、210例急性髓系白血病、316例神经母细胞瘤、128例肾母细胞瘤和89例骨肉瘤。与第1项研究相似,该研究发现许多在儿童肿瘤中发现的驱动基因(45%),既往并未在成人肿瘤中报道过。研究人员还发现62%的儿童肿瘤的遗传事件是结构改变和拷贝数变化,不是点突变[6]。
上述研究提示对于儿童肿瘤的治疗与成人肿瘤治疗方式不同,尤其是儿童肿瘤的驱动基因不同,治疗靶点也很可能区别于成人肿瘤,因此需要在儿童肿瘤中重新评估成人抗肿瘤药物,特别是靶向药物的有效性。此外,儿童肿瘤中新的突变位点的发现,也为药物研发提供了方向。
2 儿童肿瘤临床用药困境
中华人民共和国国家卫生健康委员会所发布的《新型抗肿瘤药物临床应用指导原则(2020年版)》[7]中,共列举了59个新型抗肿瘤药物(在不同系统肿瘤中重复出现的,按1个计算),其中仅帕博利珠单抗获批单药可用于治疗儿童不可切除或转移性 MSI-H 或错配修复缺陷的实体瘤以及肿瘤突变负荷高(tumor mutation burden high, TMB-H)的无法切除或转移性实体瘤;但该适应症仅在美国食品药品监督管理局(U.S. Food and Drug Administration, FDA)批准。
近年来国内抗肿瘤药物研发如火如荼,但儿童抗肿瘤药物却几乎处于空白状态。自2017年至今,仅尼洛替尼胶囊(Novartis Pharma Schweiz AG)于2019年,通过儿童适应症外推,将适应症“用于治疗新诊断的费城染色体阳性的慢性期慢性髓系白血病(chronic myelocytic leukemia, CML)(Ph+ CML)慢性期”及“用于对既往治疗(包括伊马替尼)耐药或不耐受的费城染色体阳性的Ph+ CML慢性期”的人群范围由“成人患者”扩展至“成人患者及2岁以上的儿童患者”。
儿童抗肿瘤新药研发的不足,导致超说明书用药在儿童抗肿瘤治疗过程中不可避免;然而超适应症用药无疑增加了儿童用药的安全性风险。上海交通大学医学院附属上海儿童医学中心选择了上海3所儿童专科医院,对医院药品供应目录中的儿童血液肿瘤药品进行汇总,选取每种药品(含不同厂家)的最新版药品说明书进行分析,尤其对其中的[用法用量][不良反应][禁忌][注意事项]和[儿童用药]等几个项目中的儿童用药信息进行统计评价。结果显示:在34份药品说明书中,在“用法用量”项中专项说明儿童用法用量的说明书只有13份,占比为38.2%,在这13份说明书中在“儿童用药”项中专项说明儿童用法用量特殊事宜的只有7份,占20.6%;未专项说明儿童用法用量的说明书有21份,占比为61.8%;“儿童用药”项中使用“慎用”“不推荐”或“禁止”等明确警示词语的说明书10份。在34个药品中,国产药品24个,进口药品10个,儿童用药注意事项不明确的数量国产药说明书为13份,进口药说明书为3份[9]。
儿童抗肿瘤药物的不足,最终需积极的开展药物临床研究,促进药物研发予以补充;然而现阶段国内儿童抗肿瘤药物临床试验的开展情况也不容乐观。在药物临床试验登记与信息公示平台查询(www.chinadrgutiral.org.cn),截至2021-03-09平台登记的试验总数为12 603项,而以“儿童”进行检索,共检索到临床试验501项,其中肿瘤适应症相关临床试验仅涉及4个产品的6项临床试验,其中4项是在成人健康受试者中开展的药代动力学(pharmacokinetics, PK)研究。而通过Clinicaltrials.gov网站,以“pediatric cancer”进行检索,截至2021-03-09共检索出登记临试验661项,以北美地区登记临床试验为主(表2),中国大陆登记临床试验仅为16项。
3 对儿童抗肿瘤药物研发的审评考虑
促进儿童抗肿瘤药物研发迫在眉睫,因此如何把握合理的研发节点开展科学的儿童抗肿瘤药物临床试验,是研发单位、研究者和监管机构需要关注的问题。
对于儿童人群的临床试验,伦理考量更为严格,因此,通常要求获得较为充分的数据,可支持该产品在儿童患者中预期存在疗效,并且安全性可控的情况下,再启动儿科人群药物临床试验。2015年原国家药品监督管理总局发布的《儿科人群药物临床试验技术指导原则》中指出,启动儿科人群药物临床试验的时间点根据疾病的发病特点,可以分以下两种情况。
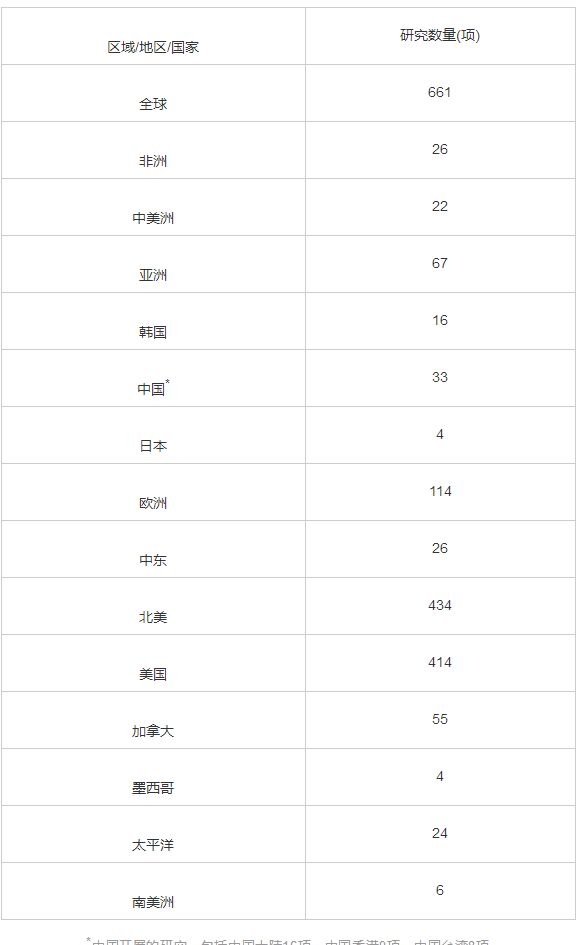
表2 全球儿童肿瘤相关临床试验开展情况(截至2021-03-09)
拟用于儿科特有疾病或患者主要为儿科人群的疾病的药物 如果成人无法提供充分信息,则在获得了健康成人的初步安全性和药代动力学数据之后,即可在目标年龄段儿科人群中开展临床试验。
拟用于成人和儿科人群共患疾病的药物 ①如果该疾病是目前缺乏有效治疗的危重症或进展性预后不良疾病,应考虑在获得成人初步安全性及潜在获益的临床试验数据后(如Ⅱ期结束或完成概念验证性研究后)尽早地开展儿科人群临床试验;②如果该疾病已有可选择的治疗药物,应在成人Ⅲ期确证性研究证明其在成人患者中的获益大于风险后,再启动儿科人群临床试验;③如果预期有较大的安全性风险,建议在该药品成人应用上市后获得充分的安全性数据。
对于儿童与成人共患肿瘤,特别是一些在儿童发病率较成人更高的瘤种或亚型(如急性淋巴细胞白血病),考虑到疾病危重,临床存在迫切的治疗需求,可在成人人群中获得初步数据并显示有效性信号后,及早开展儿科人群药物临床试验。
对于儿童特有的肿瘤,建议药物研发单位积极开展肿瘤标志物研究,或开发药效学指标;通过在成人受试者开展耐受性研究,建立可靠的药代动力学与药效学(pharmacodynamics, PD)关系;鼓励开发PK-PD模型,以支持在儿童肿瘤患者中所开展临床试验设计以及药物剂量的合理性。
对于已上市产品,特别是治疗儿童与成人共患瘤种的药物,鼓励研发单位,以科学为基础,积极开展儿童人群临床试验,探索儿童用法用量,获得产品在儿童人群中的安全有效性证据;或采用真实世界研究,以及儿童适应症外推等策略,合理及时地扩展已上市产品的儿童适应症。
4 展望
超适应症用药往往会带来以下问题:患儿可能会被开出无效的治疗处方;或者医生会因某药物无儿童适应症或儿童的用法用量,而拒绝给患儿使用潜在有效的治疗药物;此外,超适应症用药与儿童药物不良反应风险增加也息息相关[10]。为解决儿童用药困境,美国于2003年颁布《儿科研究公平法案》(Pediatric Research Equity Act, PREA),要求在所有相关儿科亚人群中进行临床研究,以评估新药,以及已批准产品新适应症、剂型和给药途径的安全性和有效性。该法规要求,在药物获得上市批准之前,需提交儿科研究,这反映出儿童用药的急迫性。2007年,FDA修正案对PREA法案进行修订,将所有延期研究指定为上市后研究,并要求FDA更好地跟踪随访这些必需的儿科研究。修订案还规定对未满足上市后儿科研究要求的公司将实施财务和其他处罚。PREA是成为美国保障儿童新药的安全性、有效性的主要机制。
在我国,尚无明确法规强制要求新药或已上市药物开展儿童研究。与成人试验相比,儿童受试者的研究通常面临更多挑战,这加剧了儿童用药的研发困境。长久以来,儿童用药始终是改革与发展的关注热点。2013年原国家食品药品监督管理总局发布《关于深化药品审评审批改革进一步鼓励创新的意见》,明确要“鼓励研制儿童用药”;2019年修订的《中华人民共和国药品管理法》,也明确指出“国家采取有效措施,鼓励儿童用药品的研制和创新”;除国家层面的政策导向,国家药品监督管理局也发布多个儿童用药研发相关指导原则(表3),其中2020年就发布了3项指导原则和1项指导原则征求意见稿,以期指导药物研发单位,更科学的开展儿童用药研发,既能为儿童用药提供充足的证据,同时避免不必要的临床研究,少走弯路。

抗肿瘤药物是新药研发中的生力军,更是药物研究创新作为活跃的领域,但是当下我国儿童抗肿瘤研发仍存在明显不足,儿童肿瘤患者有迫切的用药需求。解决儿童抗肿瘤用药困境是需要药物研发单位、研究者、监管机构共同面对的难题与挑战。药物研发单位和监管机构之间,应更加积极地就儿童抗肿瘤药物的研发进行互动,研究者也需更加积极的参与儿童抗肿瘤药物的临床试验设计与实施,通过多方努力,共同促进更多、更好的儿童抗肿瘤新药上市,及早满足肿瘤患儿的治疗需求。
参考文献
[1] STELIAROVA-FOUCHER E,STILLER C,KAATSCH P,et al .Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCIS project):An epidemiological study [J].Lancet,2004,364(9451):2097-2105.
[2] SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2016 [J].CA Cancer J Clin,2016,66(1):7-30.
[3] 张金哲.现代小儿肿瘤外科学[M].2版.北京:科学出版社,2009:3-25.
[4] 胡亚美,江载芳.诸福棠实用儿科学[M].8版.北京:人民卫生出版社,2014:2338-2345.
[5] GRÖBNER S N,WORST B C,WEISCHENFELDT J,et al.The landscape of genomic alterations across childhood cancers [J].Nature,2018,555(7696):321-327.
[6] MA X T,LIU Y,LIU Y L,et al.Pan-cancer genome and transcriptome analyses of 1699 paediatric leukaemias and solid tumours [J].Nature,2018,555(7696):371-376.
[7] 中华人民共和国国家卫生健康委员会.新型抗肿瘤药物临床应用指导原则 (2020年版)[EB/OL].北京:中华人民共和国国家卫生健康委员会,2020-12-29[2021-03-11].http://www.nhc.gov.cn/yzygj/s7659/202012/6c00e8559ee54cd29585c7f39e8a23c4.shtml.
[8] FDA.Hematology/oncology (cancer) approvals & safety notifications[EB/OL].Silver Spring:FDA,2021-01-14[2021-03-11].https://www.fda.gov/drugs/resources-information-approved-drugs/hematologyoncology-cancer-approvals-safety-notifications.
[9] 王燕琼,樊惠,任益炯.上海常用儿童抗肿瘤药物说明书存在的问题与对策研究[J].药学实践杂志,2017,35(1):78-81.
[10] HWANG T J,ORENSTEIN L,KESSELHEIM A S,et al.Completion rate and reporting of mandatory pediatric postmarketing studies under the US Pediatric Research Equity Act[J].JAMA Pediatr,2018,173(1):68-74.
目的 儿童肿瘤是当前急需攻克的医疗难题之一。儿童肿瘤与成人肿瘤在发病机制、组织来源、基因驱动等方面存在较大差异,这导致儿童肿瘤在治疗方式和潜在治疗靶点与成人不同。虽然抗肿瘤药物始终是新药研发热点,但我国儿童抗肿瘤药物研发仍十分不足,导致超说明书用药在儿童抗肿瘤治疗过程中不可避免,增加了儿童用药的安全性风险。儿童用药安全、儿童专用药品短缺等成为备受关注的问题。近年来,儿童药品领域利好政策频出,国家药品监督管理局也发布多个儿童用药相关的指导原则,为儿童抗肿瘤药物开发提供了重要机遇。
关键词:
儿童用药; 抗肿瘤药; 新药研发
Current situation and consideration of development of pediatric anti-tumor drugs
TANG Ling GAO Liu-cun MA Xiao-li WANG Xiao-ling CHEN Xiao-ming ZOU Li-min DU Yu QI Yue-li YANG Zhi-min
Center for Drug Evaluation,National Medical Products Administration Clinical Research Center,Beijing Children's Hospital, Capital Medical University,National Center of Children 's Health Department of Medical Oncology,Beijing Children's Hospital, Capital Medical University,National Center of Children 's Health Department of Pharmacy,Beijing Children's Hospital, Capital Medical University,National Center of Children 's Health
Abstract:
Children cancer is one of the medical problems to be dissolved urgently. There are significant differences between paediatric cancer and adult cancer in pathogenesis, tissue origin, gene drive, etc., which leads to differences in treatment and potential therapeutic targets. Although anti-tumor drugs have always been a hot spot in the research and development of new drugs, it is still very insufficient for paediatric anti-tumor drugs in China. Consequently drug off-label use for children cancer treatment in clinical practice is inevitable, which increases the safety risk for paediatric drug use. Paediatric drug safety and shortage of specific paediatric drugs have become an issue with much attention. In recent years, favorable policies have been frequently published in the field of paediatric drugs. The National Medical Products Administration has also issued numerous guidelines related to paediatric drugs, providing important opportunities for the research and development of paediatric anti-tumor drugs.
Keyword:
paediatric drugs; anti-tumor drugs; new drug development;
在过去的几十年里,儿童肿瘤的发病率逐步增加[1]。虽然有数据显示近年来在儿童急性淋巴细胞白血病、非霍奇金淋巴瘤、横纹肌肉瘤死亡率有较大幅度下降,但是仍有许多肿瘤,如中枢神经系统肿瘤、急性髓细胞性白血病及1岁以上的高危型神经母细胞瘤治疗十分困难。即使在发达国家,癌症仍是1岁以上儿童疾病致死的主要原因[2],长期无瘤生存率也不过60%~80%。儿童肿瘤仍是当前急需攻克的医疗难题之一[3]。
纵观药物研发,抗肿瘤药物始终是新药研发热点,但与成人抗肿瘤药物研发热度相比,儿科肿瘤药的研发明显不足。特别是我国创新药研发处于起步阶段,儿童较成人抗肿瘤药物研发差距更大,有极大的临床需求亟待满足。许多儿童肿瘤仍依赖于成人药物的超适应症用药,用法用量很多是基于成人的临床经验,这无疑加剧了儿童用药安全风险。此外,由于儿童肿瘤与成人肿瘤疾病谱的不同,一些在儿童多发,或儿童特有的肿瘤,更是缺乏安全有效的治疗手段。
1 儿童肿瘤的特点
儿童肿瘤与成人有很大的不同。多数恶性程度高、发病隐匿,局部浸润和全身转移发生早,预后与病理、临床分期、基因状态等生物学特性密切相关,单一治疗效果差,预后与总体综合治疗方案密切相关。儿童肿瘤与成人肿瘤在发病机制、组织来源、基因驱动等方面存在较大差异,这是导致儿童肿瘤在疾病类型、症状、治疗方案与成人不同的主要原因[4]。
1.1 发病原因不同
儿童肿瘤的发病原因有其自身的特点:①儿童肿瘤发病早、发病年龄小。成人肿瘤的发生可能是在某一个或几个致病因素的长期作用下,发生一系列的病变累积,最后导致肿瘤形成。从发病年龄来看,儿童肿瘤多发生在2岁前,绝大部分甚至不超过5岁,很难以环境因素长期作用致癌的理论解释。②儿童肿瘤以间叶组织来源为主。从病理组织学看,儿童肿瘤多为各种胚胎组织肿瘤和肉瘤,如神经母细胞瘤、肾母细胞瘤、肝母细胞瘤等;间叶组织并不直接接触外界环境,间叶组织肿瘤更多的是机体内环境的反映;而成人肿瘤以上皮组织来源为主,如胃癌、肺癌、直肠癌等,上皮肿瘤主要与外界环境的作用有关。③儿童肿瘤多为胚胎性肿瘤。成人肿瘤主要表现为某一细胞成分的反分化,而儿童肿瘤往往是胚胎性肿瘤,肿瘤中包含数个组织成分,并常见不同发育阶段的成分共存。④儿童存在先天性肿瘤,有些儿童肿瘤于产前诊断中发现。先天性肿瘤的存在更彰显了儿童肿瘤与胚胎发育的关系[3]。
1.2 瘤种类型具有年龄分布特点
儿童肿瘤主要分为两大类,血液淋巴系统肿瘤和实体肿瘤,前者主要包括儿童白血病和淋巴瘤,约占儿童肿瘤45%左右。后者主要包括儿童中枢神经细胞肿瘤、以神经母细胞瘤为代表的母细胞瘤类、以横纹肌肉瘤为代表的肉瘤类、生殖细胞瘤以及少见实体肿瘤,占儿童肿瘤的50%以上。
从发生年龄来看,儿童期所发生的肿瘤按年龄划分主要有以下几个阶段:第1发病高峰为出生后至3岁以内,以先天性肿瘤为主,如各种母细胞瘤、胚胎性肿瘤、畸胎瘤等;第2个高峰在10岁以后,主要见于骨肉瘤、尤文肉瘤、霍奇金淋巴瘤、甲状腺瘤及神经纤维瘤,又称为青春期肿瘤;两个高峰之间为一般的儿童期肿瘤[3]。
1.3 基因驱动差异
目前对儿童肿瘤的遗传基础尚知之甚少。最近,2项研究分析了2 600多例儿童白血病和实体肿瘤的基因组,揭示了许多驱动儿童肿瘤的突变,既往在成人肿瘤中并未发现。
在第1项研究中,研究人员分析了来自24种不同类型儿童肿瘤的961例肿瘤样本,这些要本主要来自大脑和其他实体肿瘤。研究发现儿童肿瘤的突变率比成人肿瘤低14倍。儿童肿瘤往往由单个基因的突变而引起,而且不同类别的肿瘤突变不同,但成人肿瘤则往往是由多个基因累积突变引起;儿童肿瘤具有更多生殖细胞突变,近50%的原发性儿童肿瘤含有潜在的靶向遗传事件,提示遗传易感性与儿童期肿瘤具有相关性[5]。
与以往对成人肿瘤的研究相比,儿童肿瘤的突变和成人肿瘤也有明显差异。研究显示,在儿童肿瘤突变影响最多的通路中,以与表观遗传修饰相关的基因最为常见(约占25%);成人肿瘤中最常见基因突变是PI3K相关突变基因,占比为31%;而相比之下,在儿童肿瘤中只有3%。此外,研究中所发现的儿童肿瘤驱动突变中,只有30%既往在成人肿瘤中被报道过;50%的儿童肿瘤含有预测编码药物靶点的遗传变化[5]。这些研究结果进一步证明了开发适用于儿童肿瘤驱动机制相关药物的必要性。
在第2项研究中,研究人员分析了6种儿童肿瘤的1 699例样本,包括689例B系急性淋巴细胞白血病、267例T系急性淋巴细胞白血病、210例急性髓系白血病、316例神经母细胞瘤、128例肾母细胞瘤和89例骨肉瘤。与第1项研究相似,该研究发现许多在儿童肿瘤中发现的驱动基因(45%),既往并未在成人肿瘤中报道过。研究人员还发现62%的儿童肿瘤的遗传事件是结构改变和拷贝数变化,不是点突变[6]。
上述研究提示对于儿童肿瘤的治疗与成人肿瘤治疗方式不同,尤其是儿童肿瘤的驱动基因不同,治疗靶点也很可能区别于成人肿瘤,因此需要在儿童肿瘤中重新评估成人抗肿瘤药物,特别是靶向药物的有效性。此外,儿童肿瘤中新的突变位点的发现,也为药物研发提供了方向。
2 儿童肿瘤临床用药困境
中华人民共和国国家卫生健康委员会所发布的《新型抗肿瘤药物临床应用指导原则(2020年版)》[7]中,共列举了59个新型抗肿瘤药物(在不同系统肿瘤中重复出现的,按1个计算),其中仅帕博利珠单抗获批单药可用于治疗儿童不可切除或转移性 MSI-H 或错配修复缺陷的实体瘤以及肿瘤突变负荷高(tumor mutation burden high, TMB-H)的无法切除或转移性实体瘤;但该适应症仅在美国食品药品监督管理局(U.S. Food and Drug Administration, FDA)批准。
近年来国内抗肿瘤药物研发如火如荼,但儿童抗肿瘤药物却几乎处于空白状态。自2017年至今,仅尼洛替尼胶囊(Novartis Pharma Schweiz AG)于2019年,通过儿童适应症外推,将适应症“用于治疗新诊断的费城染色体阳性的慢性期慢性髓系白血病(chronic myelocytic leukemia, CML)(Ph+ CML)慢性期”及“用于对既往治疗(包括伊马替尼)耐药或不耐受的费城染色体阳性的Ph+ CML慢性期”的人群范围由“成人患者”扩展至“成人患者及2岁以上的儿童患者”。
儿童抗肿瘤新药研发的不足,导致超说明书用药在儿童抗肿瘤治疗过程中不可避免;然而超适应症用药无疑增加了儿童用药的安全性风险。上海交通大学医学院附属上海儿童医学中心选择了上海3所儿童专科医院,对医院药品供应目录中的儿童血液肿瘤药品进行汇总,选取每种药品(含不同厂家)的最新版药品说明书进行分析,尤其对其中的[用法用量][不良反应][禁忌][注意事项]和[儿童用药]等几个项目中的儿童用药信息进行统计评价。结果显示:在34份药品说明书中,在“用法用量”项中专项说明儿童用法用量的说明书只有13份,占比为38.2%,在这13份说明书中在“儿童用药”项中专项说明儿童用法用量特殊事宜的只有7份,占20.6%;未专项说明儿童用法用量的说明书有21份,占比为61.8%;“儿童用药”项中使用“慎用”“不推荐”或“禁止”等明确警示词语的说明书10份。在34个药品中,国产药品24个,进口药品10个,儿童用药注意事项不明确的数量国产药说明书为13份,进口药说明书为3份[9]。
儿童抗肿瘤药物的不足,最终需积极的开展药物临床研究,促进药物研发予以补充;然而现阶段国内儿童抗肿瘤药物临床试验的开展情况也不容乐观。在药物临床试验登记与信息公示平台查询(www.chinadrgutiral.org.cn),截至2021-03-09平台登记的试验总数为12 603项,而以“儿童”进行检索,共检索到临床试验501项,其中肿瘤适应症相关临床试验仅涉及4个产品的6项临床试验,其中4项是在成人健康受试者中开展的药代动力学(pharmacokinetics, PK)研究。而通过Clinicaltrials.gov网站,以“pediatric cancer”进行检索,截至2021-03-09共检索出登记临试验661项,以北美地区登记临床试验为主(表2),中国大陆登记临床试验仅为16项。
3 对儿童抗肿瘤药物研发的审评考虑
促进儿童抗肿瘤药物研发迫在眉睫,因此如何把握合理的研发节点开展科学的儿童抗肿瘤药物临床试验,是研发单位、研究者和监管机构需要关注的问题。
对于儿童人群的临床试验,伦理考量更为严格,因此,通常要求获得较为充分的数据,可支持该产品在儿童患者中预期存在疗效,并且安全性可控的情况下,再启动儿科人群药物临床试验。2015年原国家药品监督管理总局发布的《儿科人群药物临床试验技术指导原则》中指出,启动儿科人群药物临床试验的时间点根据疾病的发病特点,可以分以下两种情况。

表2 全球儿童肿瘤相关临床试验开展情况(截至2021-03-09)
拟用于儿科特有疾病或患者主要为儿科人群的疾病的药物 如果成人无法提供充分信息,则在获得了健康成人的初步安全性和药代动力学数据之后,即可在目标年龄段儿科人群中开展临床试验。
拟用于成人和儿科人群共患疾病的药物 ①如果该疾病是目前缺乏有效治疗的危重症或进展性预后不良疾病,应考虑在获得成人初步安全性及潜在获益的临床试验数据后(如Ⅱ期结束或完成概念验证性研究后)尽早地开展儿科人群临床试验;②如果该疾病已有可选择的治疗药物,应在成人Ⅲ期确证性研究证明其在成人患者中的获益大于风险后,再启动儿科人群临床试验;③如果预期有较大的安全性风险,建议在该药品成人应用上市后获得充分的安全性数据。
对于儿童与成人共患肿瘤,特别是一些在儿童发病率较成人更高的瘤种或亚型(如急性淋巴细胞白血病),考虑到疾病危重,临床存在迫切的治疗需求,可在成人人群中获得初步数据并显示有效性信号后,及早开展儿科人群药物临床试验。
对于儿童特有的肿瘤,建议药物研发单位积极开展肿瘤标志物研究,或开发药效学指标;通过在成人受试者开展耐受性研究,建立可靠的药代动力学与药效学(pharmacodynamics, PD)关系;鼓励开发PK-PD模型,以支持在儿童肿瘤患者中所开展临床试验设计以及药物剂量的合理性。
对于已上市产品,特别是治疗儿童与成人共患瘤种的药物,鼓励研发单位,以科学为基础,积极开展儿童人群临床试验,探索儿童用法用量,获得产品在儿童人群中的安全有效性证据;或采用真实世界研究,以及儿童适应症外推等策略,合理及时地扩展已上市产品的儿童适应症。
4 展望
超适应症用药往往会带来以下问题:患儿可能会被开出无效的治疗处方;或者医生会因某药物无儿童适应症或儿童的用法用量,而拒绝给患儿使用潜在有效的治疗药物;此外,超适应症用药与儿童药物不良反应风险增加也息息相关[10]。为解决儿童用药困境,美国于2003年颁布《儿科研究公平法案》(Pediatric Research Equity Act, PREA),要求在所有相关儿科亚人群中进行临床研究,以评估新药,以及已批准产品新适应症、剂型和给药途径的安全性和有效性。该法规要求,在药物获得上市批准之前,需提交儿科研究,这反映出儿童用药的急迫性。2007年,FDA修正案对PREA法案进行修订,将所有延期研究指定为上市后研究,并要求FDA更好地跟踪随访这些必需的儿科研究。修订案还规定对未满足上市后儿科研究要求的公司将实施财务和其他处罚。PREA是成为美国保障儿童新药的安全性、有效性的主要机制。
在我国,尚无明确法规强制要求新药或已上市药物开展儿童研究。与成人试验相比,儿童受试者的研究通常面临更多挑战,这加剧了儿童用药的研发困境。长久以来,儿童用药始终是改革与发展的关注热点。2013年原国家食品药品监督管理总局发布《关于深化药品审评审批改革进一步鼓励创新的意见》,明确要“鼓励研制儿童用药”;2019年修订的《中华人民共和国药品管理法》,也明确指出“国家采取有效措施,鼓励儿童用药品的研制和创新”;除国家层面的政策导向,国家药品监督管理局也发布多个儿童用药研发相关指导原则(表3),其中2020年就发布了3项指导原则和1项指导原则征求意见稿,以期指导药物研发单位,更科学的开展儿童用药研发,既能为儿童用药提供充足的证据,同时避免不必要的临床研究,少走弯路。

抗肿瘤药物是新药研发中的生力军,更是药物研究创新作为活跃的领域,但是当下我国儿童抗肿瘤研发仍存在明显不足,儿童肿瘤患者有迫切的用药需求。解决儿童抗肿瘤用药困境是需要药物研发单位、研究者、监管机构共同面对的难题与挑战。药物研发单位和监管机构之间,应更加积极地就儿童抗肿瘤药物的研发进行互动,研究者也需更加积极的参与儿童抗肿瘤药物的临床试验设计与实施,通过多方努力,共同促进更多、更好的儿童抗肿瘤新药上市,及早满足肿瘤患儿的治疗需求。
参考文献
[1] STELIAROVA-FOUCHER E,STILLER C,KAATSCH P,et al .Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCIS project):An epidemiological study [J].Lancet,2004,364(9451):2097-2105.
[2] SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2016 [J].CA Cancer J Clin,2016,66(1):7-30.
[3] 张金哲.现代小儿肿瘤外科学[M].2版.北京:科学出版社,2009:3-25.
[4] 胡亚美,江载芳.诸福棠实用儿科学[M].8版.北京:人民卫生出版社,2014:2338-2345.
[5] GRÖBNER S N,WORST B C,WEISCHENFELDT J,et al.The landscape of genomic alterations across childhood cancers [J].Nature,2018,555(7696):321-327.
[6] MA X T,LIU Y,LIU Y L,et al.Pan-cancer genome and transcriptome analyses of 1699 paediatric leukaemias and solid tumours [J].Nature,2018,555(7696):371-376.
[7] 中华人民共和国国家卫生健康委员会.新型抗肿瘤药物临床应用指导原则 (2020年版)[EB/OL].北京:中华人民共和国国家卫生健康委员会,2020-12-29[2021-03-11].http://www.nhc.gov.cn/yzygj/s7659/202012/6c00e8559ee54cd29585c7f39e8a23c4.shtml.
[8] FDA.Hematology/oncology (cancer) approvals & safety notifications[EB/OL].Silver Spring:FDA,2021-01-14[2021-03-11].https://www.fda.gov/drugs/resources-information-approved-drugs/hematologyoncology-cancer-approvals-safety-notifications.
[9] 王燕琼,樊惠,任益炯.上海常用儿童抗肿瘤药物说明书存在的问题与对策研究[J].药学实践杂志,2017,35(1):78-81.
[10] HWANG T J,ORENSTEIN L,KESSELHEIM A S,et al.Completion rate and reporting of mandatory pediatric postmarketing studies under the US Pediatric Research Equity Act[J].JAMA Pediatr,2018,173(1):68-74.
相关文章



